实时荧光PCR (rtPCR) 是目前应用最广的核酸检测技术,检测模式采用闭管检测,相对于开管检测而言,rtPCR极大降低了扩增产物的污染机会,节省了时间和人力,便于实现自动化,更可以利用阈循环数(Cq值)支持定量检测。然而,rtPCR的一个很大局限在于单个反应所能检测的靶基因数目有限。根据目前主流荧光PCR仪器检测通道数目,单个反应所能检测的靶基因数目很难超过4-6个,限制了该技术在涉及多靶点的复杂疾病上的应用。在PCR反应后添加熔解分析步骤,可在一定程度上增加可检测靶基因数目,但是,伴随荧光探针类型的增加,荧光背景及检测成本也随之升高,尤其是,探针结合区任何核酸变异都可能引起熔点偏移,导致结果误判,使得该法对于靶标数目的提升依然受限。与那些广受瞩目的高通量检测技术相比,已有30年历史的rtPCR似乎正成为一种“低阶”核酸检测技术。
在2022年2月24日在线发表于《美国国家科学院院刊》(PNAS)的一项研究中,我中心李庆阁团队报道了一种称为“MeltArray”的荧光PCR新技术,一举将荧光PCR的单管检测能力提高到一个数量级以上,并通过多个临床应用场景,系统展示了该技术强大而灵活的检测能力。

“MeltArray”巧妙地利用了Taq DNA聚合酶的5'-瓣状内切酶活性,在PCR反应中,该活性将位于引物下游的“媒介探针”切割,生成“媒介引物”,“媒介引物”进而与分子信标报告探针结合,在Taq酶聚合活性作用下,沿着分子信标延伸生成具有特定熔点的荧光双链,最终使媒介探针特异识别的靶标获得一个包括荧光类型和熔点值的“二维”标记。由于每个分子信标可以允许多个媒介引物形成一系列具有不同熔点的荧光双链,单个MeltArray多重荧光PCR反应可检测的总靶基因数目就等于反应中分子信标数目乘以其所容纳的媒介引物数目。作者在文中展示了单个荧光通道可检测12个靶标,6个荧光通道的仪器可以检测多达72个靶标!这是单个闭管PCR一步法迄今所能检测的最大靶基因数目。
该技术实现的关键是获取一种具有“多泊位”的报告探针,以容纳众多的媒介引物。研究人员首先比较了线性探针和分子信标分别用作报告探针的优劣,分子信标因具有清晰的背景而胜出。接着,作者考察了分子信标的“多泊位”能力。他们小心翼翼地从两重PCR开始,首先证明一个分子信标可以允许两个“媒介引物”停泊;又通过一个四重PCR,证明了一个分子信标可以允许四个“媒介引物”叠加式停泊,由此,提出了一个分子信标可以容纳任意多个媒介引物的假设。根据目前荧光PCR仪器的熔点分辨率,利用两个分子信标,实验验证了单个荧光通道即可检测12个靶基因。最后研究人员构建了一个阵列式结构的“媒介子”库及其对应的分子信标报告探针,以实现检测的标准化。为降低多重PCR中多对引物并存可能产生的引物二聚体干扰,研究人员又引入了“PCR抑制”概念,至此提出了MeltArray的完整技术原理(图1)。
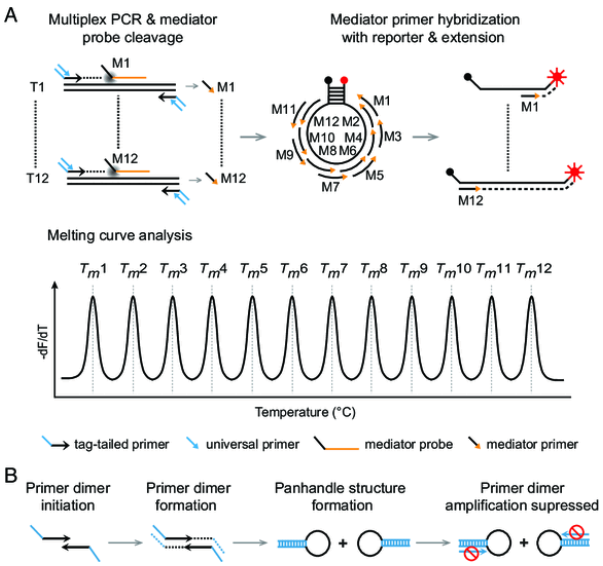
图1 MeltArray的技术原理
为验证MeltArray的多重检测能力,作者首先设计了一个20重PCR的 MelArray检测体系,覆盖人类Y染色体无精子因子区域 (AZFa、AZFb、AZFc和AZFd)的18个序列标签位点和2个参照基因(SRY基因和ZFX/Y基因)。在正常男性样本,20个位点全部存在,即均有熔解峰,而患者男性则会出现1个或多个熔解峰的缺失——该实验是一个典型的多靶标同时出现的例子(图2)。实验结果表明,该MelArray体系仅利用三个荧光通道,就实现了20个靶标的同时检出。为评估模板量对MeltArray检测能力的影响,作者考察了从100 ng到100 pg的健康男性和女性的基因组DNA,在该范围内,所有模板均被稳定检出。随着DNA模板量的逐渐降低,熔解峰高度有所下降,但20个峰的熔点值均未发生变化。最后,作者通过对757份样本的双盲检测,证实了MeltArray体系的准确性。
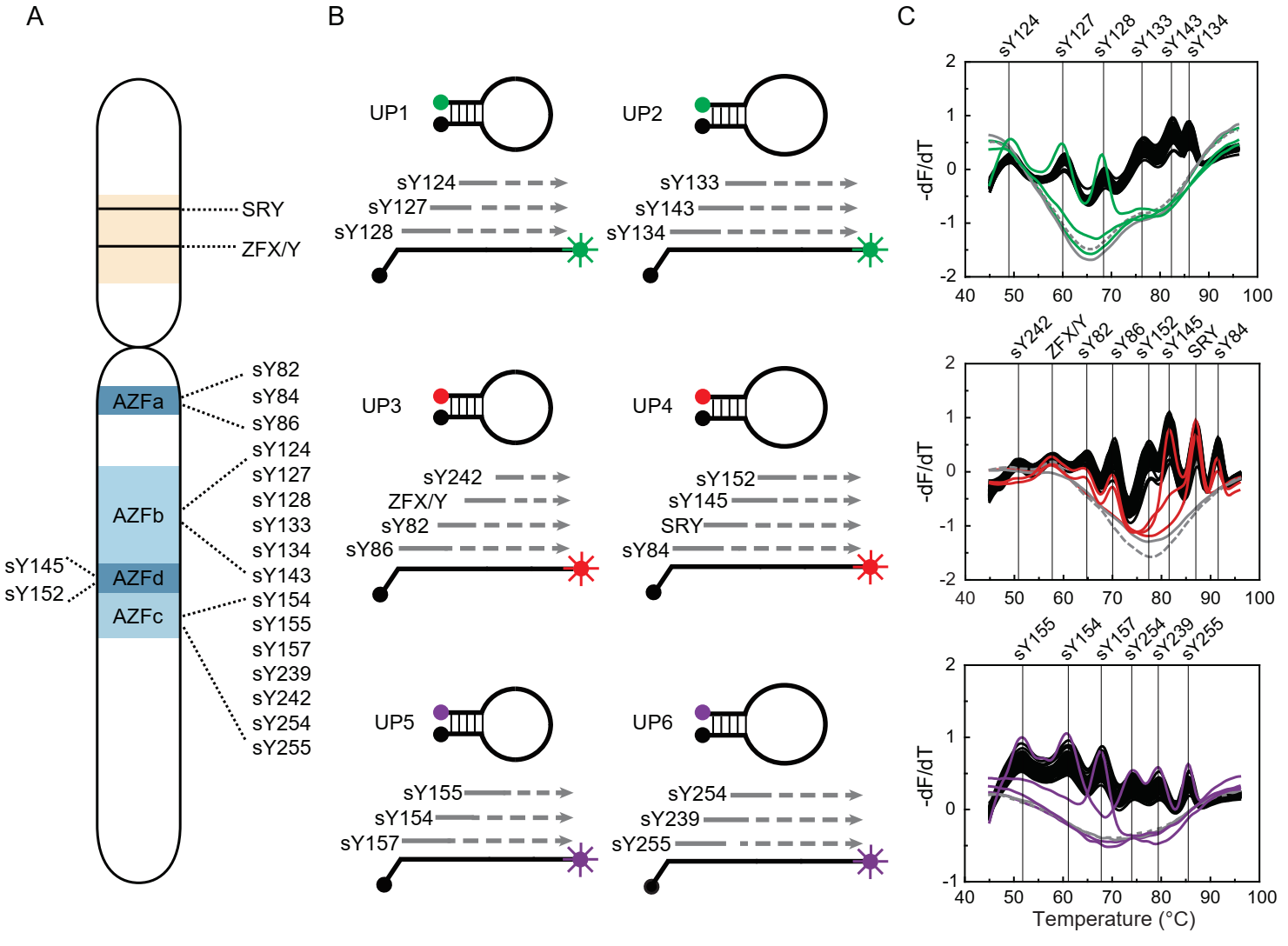
图2 MeltArray技术应用于20重人类Y染色体微缺失的检测
受以上结果鼓舞,作者开始挑战更多的靶标数目。这次,他们使用六个荧光通道设计了一个62重PCR的MeltArray检测体系(图3),用于识别61种O抗原合成基因及1个大肠杆菌管家基因yccT。我们看一下此时每个通道的检测数目,按照荧光波长从低到高的次序,六个荧光通道检测的靶标数目分别是11、9、12、12、8和10个!各个通道的重复实验结果采用3倍标准偏差显示,每一个靶标对应的熔点值均稳定且能明确区分。最后,作者利用该体系鉴定了167株大肠杆菌培养株的血清型,除了覆盖范围之外的4株,检测结果与全基因组测序结果完全一致,而且比传统抗血清法多鉴定出11株,还另外纠正了其鉴定错误的1株。
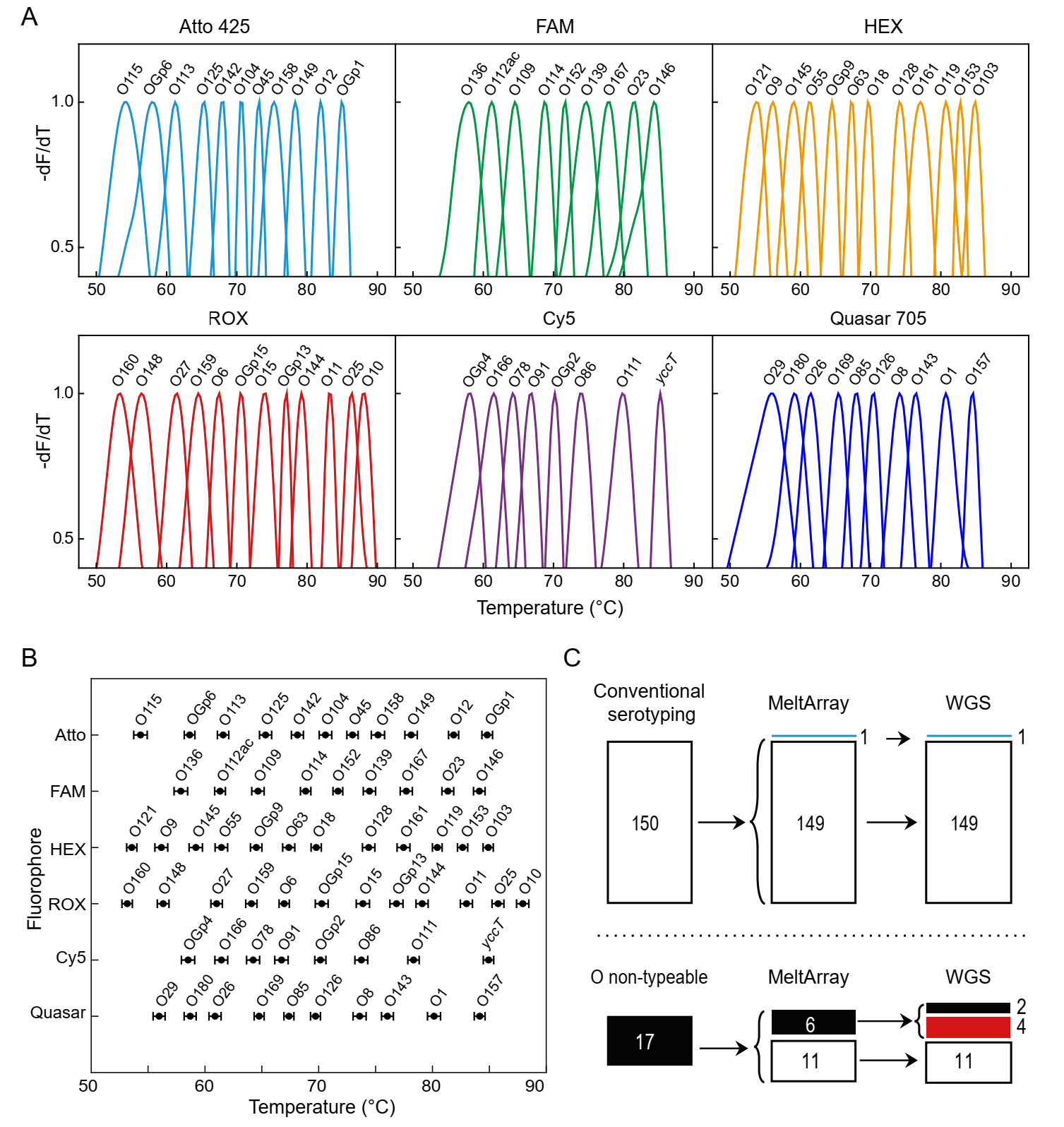
图3 MeltArray技术用于61种大肠杆菌O血清型分型
上述两个例子均为定性检测,那么,MeltArray可否另外进行定量检测呢?为回答这一问题,研究团队设计了一个24重PCR的呼吸道病原体检测体系(图4),他们将其中的19种非定植菌/病毒和1个内控基因设置为熔解分析模式,即定性检测;另外4种细菌设置为实时PCR检测模式——即TaqMan探针模式,即定量检测。需要指出的是,作者选择变性阶段进行实时荧光检测。他们相信,实时检测的对象是探针酶切后积累的荧光信号,无论变性阶段还是延伸阶段,检测结果应该一致。在变性阶段,任何报告探针产生的荧光都会趋于一致,而不影响实时检测结果。事实证明了作者的这一设想。该体系在定性检测19种靶基因的同时,成功实现了4种靶基因的定量检测。24重PCR的MeltArray检测体系分析灵敏度达10 copies/μl。通过对67份肺炎或呼吸道感染患者的肺泡灌洗液样本的验证,证实了检测结果的可靠性。

图4 实时PCR和熔解曲线分析同时应用于呼吸道病原体的定性和定量检测
突变分析是核酸检测另一重要应用领域,为考察MeltArray可否用于突变分析,研究团队以KRAS突变为例,设计了一个称为“微测序”的突变鉴定体系,即在单个反应管内一一鉴定出发生在KRAS基因密码子12和密码子13上的9种类型的突变(图5)。在这里,作者利用了探针杂交的特异性,利用10条媒介探针,对上述9种突变类型和野生型分别加以二维标记。实验表明,该体系具有极佳的突变检测特异性,可耐受高达500 ng的野生型基因组DNA,可检测的突变等位基因频率达到5%-10%,优于Sanger测序——其最低突变等位基因频率在10%-20%之间,检测限低至30个拷贝每反应。最后作者利用该体系检测了167份结直肠癌组织样本的KRAS突变类型,获得了与Cosmic数据库一致的突变频率分布,同时也表明,MeltArray比Sanger测序具有更灵敏的突变检测能力。

图5 MeltArray技术用于KRAS突变的微测序
MeltArray的以上四个应用场景,实际上对应了分子诊断的三大应用领域,即遗传病、传染病(又分别涉及到病原体鉴定及病原体定性、定量检测这些细分领域)和肿瘤的分子诊断,显示出MeltArray做为通用核酸检测技术的典型特征。当前,实现类似靶标数目的检测均需“开管检测”技术,如芯片、质谱、微球、电泳等,然而这些技术普遍存在设备昂贵,操作复杂、周转时间长等缺点,且国产化率低,在国内外市场上不温不火,长期进展缓慢。相对而言,MeltArray采用广泛可及且已国产化的荧光PCR仪器,具有明显的成本低、操作简便、自动化程度高、周转时间短等诸多优势,结合本文所展现的强大而灵活的技术优势,不仅成功推动荧光PCR这一“老技术”再上“新台阶”,也完美填补了长期存在于低阶PCR和高通量检测二者之间的技术空白!
厦门大学生命科学学院黄秋英助理教授、博士生陈冬梅、杜琛为共同第一作者,生命科学学院李庆阁教授、公共卫生学院廖逸群副教授为共同通讯作者,共同作者包括厦门大学硕士生刘巧巧、林素、梁兰兰、许晔副教授。该研究得到了国家科技重大专项(No. 2017ZX10302301 & No. 2017ZX10303406)、国家自然科学基金(No. 81672110)、福建省社会发展高校产学合作项目(No. 2019Y4002)、厦门市科技计划项目(No. 3502Z201830070 & No. 3502Z20183013)的资助。本文所描述的MeltArray技术已在中国、美国、欧洲、日本、韩国获得专利授权,并向澳大利亚等国递交了专利申请。
李庆阁团队长期从事荧光PCR尤其是多重荧光技术平台研究,2001年报告一种新的寡核苷酸杂交反应模式(Nucleic Acids Research),发明置换探针和置换引物(中、美、日、澳及欧洲专利授权);2004年提出置换探针基因分型技术(Nucleic Acids Research);2006年发明探针编码实时PCR(Clinical Chemistry,中国发明专利授权);2011提出自淬灭探针的多色探针熔解曲线变异分析技术(Journal of Molecular Diagnostics,中、美专利授权),2013年提出基于连接反应的“荧光—熔点”二维标记技术(Nucleic Acids Research, 中、美、欧洲专利授权)。
论文链接:https://www.pnas.org/content/119/9/e2110672119
(图/文 李庆阁课题组)
